پنیر موزارلای شما کش نمیآید یا میسوزد؟ راز آن در علم نهفته است. از فرآیند پاستا فیلاتا تا نقش «کهنگی» و قندها در...
جستجو در بلاگ
دستهبندی بلاگ
آخرین ارسالها

سالاد هویج فرانسوی (Carottes Râpées) یک پیش غذای سالم و خوشمزه است که در کمتر از ۱۵ دقیقه آماده میشود. این سالاد...

آیا میدانستید تغییر فصلها بر سلامت، خلقوخو و ژنهای شما تأثیر میگذارد؟ کشف کنید که چگونه با طبیعت هماهنگ شوید و...
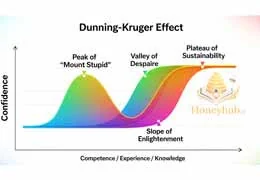
اثر دانینگ-کروگر چیست و چگونه بر زندگی ما تأثیر میگذارد؟ در این پست جذاب، با چرخه معیوب جهل و اعتماد به نفس آشنا...

در این مقاله جامع، با عسل آفتابگردان، خواص درمانی و بیوشیمیایی آن، تاریخچه، و روش تشخیص عسل خالص آشنا شوید.
پستهای محبوب





پستهای ویژه








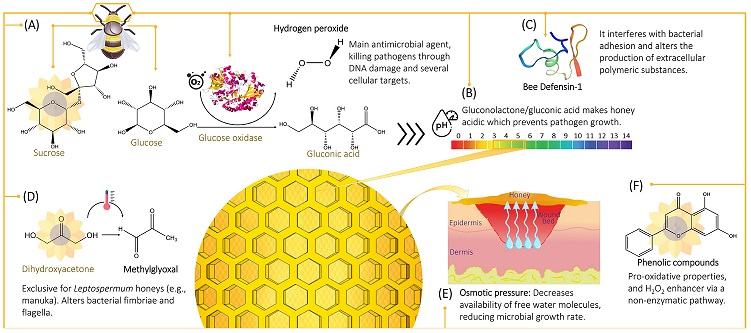 شکل 1. اجزای کلیدی ضد میکروبی عسل. ( الف ) ساکارز گلها توسط زنبور عسل به گلوکز و فروکتوز تجزیه می شود. غدد هیپوفارنکس زنبور عسل GOx ترشح می کنند. سپس گلوکز توسط فرم اکسید شده GOx اکسید می شود که منجر به تولید گلوکونولاکتون/گلوکونیک اسید و H 2 O 2 می شود . بیشتر فعالیت ضد میکروبی عسل از H 2 O 2 ناشی می شود و پاتوژن ها را از طریق آسیب DNA و اهداف سلولی از بین می برد. ( ب ) عسل با pH متوسط 3.91 (محدوده بین 3.4 تا 6.1) اسیدی است که آن را در برابر سویه های میکروبی با pH بهینه رشد حدود 7 قدرتمند می کند. اسیدیته عمدتاً از گلوکونولاکتون/گلوکونیک اسید ناشی می شود. (ج)Bee Def-1 یک پپتید ضد باکتری است که از غده هیپوفارنکس زنبور عسل منشا می گیرد. با تداخل در چسبندگی باکتری به سطح یا در مرحله اولیه بیوفیلم با مهار رشد سلول های متصل و با تغییر در تولید مواد پلیمری خارج سلولی عمل می کند. (د) MGO در عسل در طول ذخیره سازی با تبدیل غیر آنزیمی دی هیدروکسی استون، ساکاریدی که در غلظت های بالا در شهد گل لپتوسپرم یافت می شود، تولید می شود . فعالیت ضد میکروبی MGO به تغییرات در فیمبریا و تاژک های باکتریایی نسبت داده می شود که مانع از چسبیدن و حرکت باکتری می شود. (ن) عسل محلول فوق اشباع قندها است. برهمکنش قوی بین این قندها با مولکول های آب از فراوانی مولکول های آب آزاد (فعالیت کم آب) در دسترس برای رشد میکروب ها جلوگیری می کند. (و) ترکیب فنل های مختلف به عنوان تقویت کننده اثر ضد میکروبی عسل عمل می کند. در شرایط قلیایی (pH 7.0-8.0)، پلی فنل ها می توانند خواص پرواکسیداتیو را نشان دهند و با تسریع تشکیل رادیکال های هیدروکسیل و شکستن رشته اکسیداتیو در DNA، رشد میکروبی را مهار کنند. آنها همچنین می توانند از تولید مقادیر قابل توجهی H 2 O 2 از طریق یک مسیر غیر آنزیمی پشتیبانی کنند.
شکل 1. اجزای کلیدی ضد میکروبی عسل. ( الف ) ساکارز گلها توسط زنبور عسل به گلوکز و فروکتوز تجزیه می شود. غدد هیپوفارنکس زنبور عسل GOx ترشح می کنند. سپس گلوکز توسط فرم اکسید شده GOx اکسید می شود که منجر به تولید گلوکونولاکتون/گلوکونیک اسید و H 2 O 2 می شود . بیشتر فعالیت ضد میکروبی عسل از H 2 O 2 ناشی می شود و پاتوژن ها را از طریق آسیب DNA و اهداف سلولی از بین می برد. ( ب ) عسل با pH متوسط 3.91 (محدوده بین 3.4 تا 6.1) اسیدی است که آن را در برابر سویه های میکروبی با pH بهینه رشد حدود 7 قدرتمند می کند. اسیدیته عمدتاً از گلوکونولاکتون/گلوکونیک اسید ناشی می شود. (ج)Bee Def-1 یک پپتید ضد باکتری است که از غده هیپوفارنکس زنبور عسل منشا می گیرد. با تداخل در چسبندگی باکتری به سطح یا در مرحله اولیه بیوفیلم با مهار رشد سلول های متصل و با تغییر در تولید مواد پلیمری خارج سلولی عمل می کند. (د) MGO در عسل در طول ذخیره سازی با تبدیل غیر آنزیمی دی هیدروکسی استون، ساکاریدی که در غلظت های بالا در شهد گل لپتوسپرم یافت می شود، تولید می شود . فعالیت ضد میکروبی MGO به تغییرات در فیمبریا و تاژک های باکتریایی نسبت داده می شود که مانع از چسبیدن و حرکت باکتری می شود. (ن) عسل محلول فوق اشباع قندها است. برهمکنش قوی بین این قندها با مولکول های آب از فراوانی مولکول های آب آزاد (فعالیت کم آب) در دسترس برای رشد میکروب ها جلوگیری می کند. (و) ترکیب فنل های مختلف به عنوان تقویت کننده اثر ضد میکروبی عسل عمل می کند. در شرایط قلیایی (pH 7.0-8.0)، پلی فنل ها می توانند خواص پرواکسیداتیو را نشان دهند و با تسریع تشکیل رادیکال های هیدروکسیل و شکستن رشته اکسیداتیو در DNA، رشد میکروبی را مهار کنند. آنها همچنین می توانند از تولید مقادیر قابل توجهی H 2 O 2 از طریق یک مسیر غیر آنزیمی پشتیبانی کنند.
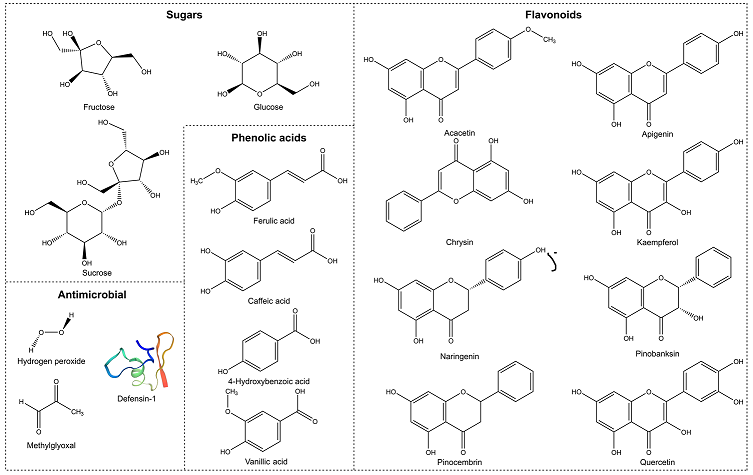 شکل 2. ترکیباتی که می توانند به خواص ضد میکروبی کلی عسل کمک کنند، از جمله H 2 O 2 ، def-1 (Swissmodel, P17722) [ 35 ]، MGO ( فقط عسل های ( گیاهان تیره درخت چایLeptospermum ) فلاونوئیدها، اسیدهای فنولیک و قندها.
شکل 2. ترکیباتی که می توانند به خواص ضد میکروبی کلی عسل کمک کنند، از جمله H 2 O 2 ، def-1 (Swissmodel, P17722) [ 35 ]، MGO ( فقط عسل های ( گیاهان تیره درخت چایLeptospermum ) فلاونوئیدها، اسیدهای فنولیک و قندها.
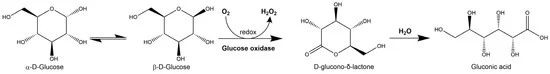 شکل 3. نمایش شماتیک واکنش آنزیمی بین گلوکز اکسیداز و گلوکز برای تولید H 2 O 2 و اسید گلوکونیک.
شکل 3. نمایش شماتیک واکنش آنزیمی بین گلوکز اکسیداز و گلوکز برای تولید H 2 O 2 و اسید گلوکونیک.

 هانی هاب
دانشنامه عسل
هانی هاب
دانشنامه عسل
 عسلک در مقایسه با عسل شکوفه، محتوای H2O2 بیشتری تولید می کند [
عسلک در مقایسه با عسل شکوفه، محتوای H2O2 بیشتری تولید می کند [
آخرین نظرات